Незважаючи на десятиліття зниження смертності завдяки ранньому виявленню та вдосконаленню лікування, рак молочної залози (РМЗ) залишається другою провідною причиною смерті від раку серед жінок. Даний вид патології зустрічається в кожній країні світу, та є найпоширенішим онкологічним захворюванням серед жінок у 157 країнах зі 185 [1]. Всесвітня організація охорони здоров’я прогнозує, що до 2050 року кількість випадків РМЗ у світі зросте майже на 38%, а смертність від цього виду раку – на 68% [2]. В Україні РМЗ становить 22,5% усіх онкологічних захворювань [3].
Приблизно 99% РМЗ виникає у жінок і 0,5-1% у чоловіків [3].
Чому так відбувається?
Це пов’язано зі значно вищим рівнем впливу естрогену та прогестерону впродовж життя. У жінок частіше відбуваються коливання рівнів статевих гормонів, особливо в пременопаузі та постменопаузі, що підвищує ризик розвитку захворювання. Крім того, після менопаузи ризик раку молочної залози залишається підвищеним через позитивну кореляцію між рівнями циркулюючих естрогенів і андрогенів та ризиком захворювання [4].
Іншими факторами ризику розвитку РМЗ є: вік (понад 40 років), ожиріння, вживання алкоголю, паління, порушення сну, депресивні симптоми, гормональна терапія в постменопаузі, радіаційне опромінення в анамнезі, ранній початок менструацій і пізня перша вагітність. При цьому близько половини випадків у жінок розвивається без виявлених факторів, окрім віку і статі [5].
Лікування РМЗ ускладнюється тим, що більшість людей не відчувають жодних симптомівна ранній стадії, коли хворобу ще можна ефективно контролювати.
Через це надзвичайно важливим є своєчасне виявлення шляхом регулярних профілактичних обстежень, таких як мамографія, клінічний огляд та самообстеження молочних залоз [6].
Важливо знати!
РМЗ може проявлятися низкою симптомів, зокрема: ущільненням у молочній залозі (часто без болю), змінами форми, розміру або зовнішнього вигляду грудей, появою почервоніння, ямочок на шкірі, змінами в області соска або виділеннями з нього. Захворювання починається з неконтрольованого росту аномальних клітин у протоках або часточках молочної залози. Найбільш рання форма не загрожує життю, однак за відсутності лікування рак може перейти в агресивну форму, поширюючись на прилеглі тканини, лімфатичні вузли або метастазувати в інші органи, що значно ускладнює терапію і може призвести до летального наслідку [7].
-----------------
Розвиток знань про РМЗ та удосконалення методів його лікування є результатом понад столітньої еволюції медичних досліджень, клінічних спостережень і технологічних проривів.
Ключові етапи становлення сучасної онкологічної медичної практики включають: проведення першої радикальної мастектомії В. С. Холстедом у 1882 році, яка надовго стала золотим стандартом хірургічного лікування тяжких форм РМЗ [8]. Хоча це дозволило підвищити виживаність пацієнток на той час, операція включала видалення не лише молочної залози, а й великого грудного м’яза та регіонарних лімфовузлів, що призводило до значного фізичного каліцтва.
У 1895 році відбулося відкриття рентгенівських променів, що дало розвиток візуалізаційним технологіям, зокрема мамографії, яка стала основним методом скринінгу [10]. Відкриття радію та полонію (М. та П. Кюрі) у 1898 році призвело до перших спроб застосування радіоактивного випромінювання для терапії злоякісних пухлин. Поява радіотерапії дозволила зменшити обсяг хірургічного втручання. Згодом було запропоновано модифікований варіант мастектомії – менш травматичний та більш прийнятний з функціональної й естетичної точки зору [8].
Наступним етапом стало застосування брахітерапії в якості додаткового лікування після операції з метою локального контролю над пухлиною [11].
Згодом було ідентифіковано онкоген HER2, надекспресія якого асоційована з агресивним клінічним перебігом пухлини та резистентністю до стандартної терапії. Подальші дослідження демонстрували еквівалентну ефективність лампектомії з опроміненням та радикальної мастектомії при ранніх стадіях захворювання [8].
Історія фармакотерапії РМЗ бере свій початок із застосування радіоактивних ізотопів радію та полонію. Радіофармація тривалий час залишалась одним із основних методів лікування злоякісних пухлин, зокрема й РМЗ.
! Увага дослідників зосередилася не лише на локальному впливі, а й на можливостях системної дії на пухлинний процес.
Саме це зумовило перехід до пошуку фармакологічних засобів, здатних впливати на ріст і розповсюдження пухлини.
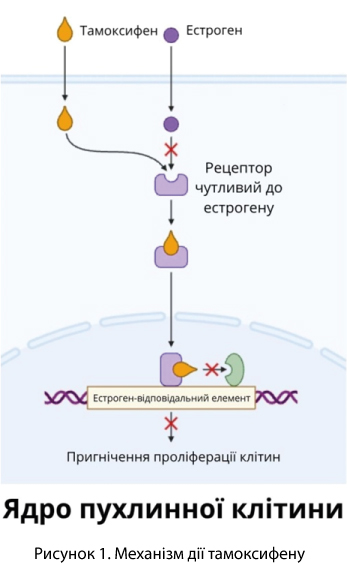
У 1978 році відбулося схвалення FDA ТАМОКСИФЕНУ – першого представника класу селективних модуляторів естрогенових рецепторів (SERM), для лікування гормонзалежного РМЗ [12]. За механізмом дії (рисунок 1) тамоксифен умовно імітує гормон естроген. Його можна представити як «ключ», який: проникає в клітину та намагається «відкрити замок» – естрогеновий рецептор. Препарат зв’язується з рецептором, але не активує його повністю, як це робить естроген, як результат – дія естрогену пригнічується, бо його «місце» вже зайняте, і клітина не отримує сигнал до росту. Це особливо важливо для РМЗ, чутливого до естрогенів. Блокуючи рецептори, тамоксифен гальмує ріст пухлини.
У 1998 встановлено профілактичну ефективність тамоксифену: зниження ризику розвитку РМЗ у жінок із високим базовим ризиком до 50% [12].
Пізніше препарат РАЛОКСИФЕН продемонстрував порівнянну ефективність у профілактиці РМЗ у постменопаузальних жінок із кращим профілем безпеки порівняно з тамоксифеном [15].
Далі відбулося виділення та клонування BRCA1/2, мутації в яких зумовлюють спадкову схильність до розвитку РМЗ. 1996 року схвалено АНАСТРОЗОЛ, інгібітор ароматази, для лікування естроген-чутливого раку у жінок у постменопаузі [13].
Більшість випадків РМЗ у жінок після менопаузи – естроген-позитивні (ER+) [14].
Що це означає?
Естроген стимулює їхній ріст, тож зменшення гормону в крові має прямий терапевтичний ефект. У жінок після менопаузи яєчники припиняють вироблення естрогенів, але організм має здатність синтезувати їх в жировій тканині, печінці, м’язах. Таким чином гормон андростендіон (тип андрогену) перетворюється в естрон, а потім в естрадіол – основний активний естроген. Це перетворення відбувається під дією ферменту ароматази. Анастрозол блокує ароматазу, таким чином перериває реакцію перетворення андрогенів на естрогени. Як результат, рівень естрадіолу різко знижується, а гормонозалежні ракові клітини втрачають ресурс для росту й розмноження.
Наступним важливим кроком стало клонування гена HER2, яке заклало основу для створення таргетних препаратів. FDA затверджує ТРАСТУЗУМАБ (Herceptin) у 1998 році – перший таргетний препарат, спрямований проти HER2-позитивних пухлин.
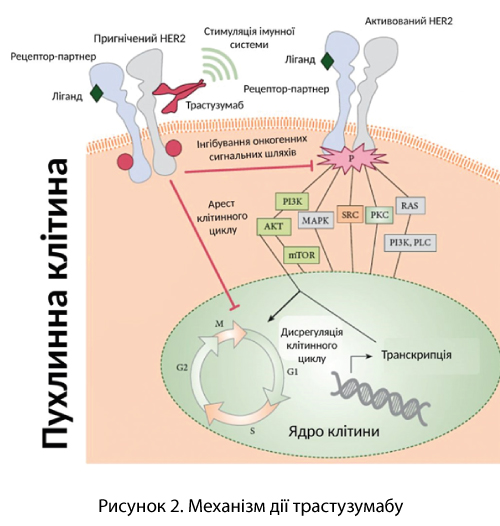
Таргетна терапія стала справжнім проривом, оскільки вона дозволяє діяти точково – виключно на клітини, що мають специфічні мішені. На сьогодні яскравими прикладами є лікування HER2-позитивного підтипу раку молочної залози за допомогою моноклональних антитіл – трастузумабу (який досі є одним з провідних препаратів при РМЗ), ПЕРТУЗУМАБУ, або їх комбінацій з іншими препаратами. Ці антитіла зв’язуються з рецептором HER2, що надмірно експресується на поверхні ракових клітин, блокуючи сигнали, які стимулюють проліферацію. Зв'язування трастузумабу з HER2 пригнічує активацію сигнальних шляхів HER2, незалежних від ліганду. Це зв'язування запобігає протеолітичному розщепленню його позаклітинного домену та механізму активації HER2 (рисунок 2).
FDA схвалило Ogivri – перший біосиміляр трастузумабу, що зробив таргетну терапію HER2-позитивного РМЗ більш доступною [16]. Наступним кроком було схвалено трастузумаб-дерукстекан (Enhertu) – кон’югат антитіла з цитостатиком, який показав високу ефективність при резистентному HER2-позитивному метастатичному РМЗ. У 2020 FDA затвердило сацитузумаб-говітекан (Trodelvy) для терапії метастатичного тричі негативного РМЗ у пацієнток після попередніх ліній лікування.
Історичний аналіз ключових етапів розвитку підходів до лікування РМЗ демонструє безперервний поступ від радикальних хірургічних втручань до персоналізованої, молекулярно-орієнтованої терапії. Впровадження в клінічну практику променевої терапії, гормональних препаратів, таргетних засобів та біомаркерної діагностики стало можливим завдяки стрімкому розвитку фундаментальних наук – генетики, молекулярної біології та фармакології.
Важливо розуміти!
Сучасна онкологія базується не лише на морфологічній класифікації пухлин, але й на їхній молекулярній гетерогенності, що забезпечує індивідуалізований підхід до терапії пацієнтів та підвищення її ефективності при зменшенні токсичності. Ці здобутки створили надійне підґрунтя для подальших досліджень у напрямі таргетної, імуно- та генної терапії.
На сьогодні РМЗ розглядається як гетерогенне захворювання, що включає кілька підтипів із різними біологічними характеристиками та механізмами впливу на організм. Ідентифікація специфічних генів та молекулярна класифікація пухлин стали фундаментом для розробки більш персоналізованих та ефективних стратегій лікування.
До основних методів лікування РМЗ належать: хірургічне втручання, променева терапія та застосування лікарських препаратів.
Які саме методи будуть застосовані при розробці схеми лікування, в якому порядку та в яких дозуваннях – усе це визначається індивідуально для кожного пацієнта. Рішення ухвалюється з урахуванням етіології захворювання, анамнезу, результатів клінічних, лабораторних та інструментальних досліджень. Розробкою схеми та стратегії лікування займається мультидисциплінарна команда фахівців, до складу якої, як правило, входять онколог, онкохірург та лікар з променевої терапії.
Згідно з протоколами лікування МОЗ обов’язковим компонентом лікування є медикаментозна терапія, яка включає хіміотерапію, гормональну терапію, а також терапію прикриття й супроводу. Окрім того, важливою складовою є лікування важких реакцій та ускладнень, що проводиться згідно з рекомендаціями онкологів.
У 2013 році молекулярна класифікація РМЗ визначила підтипи:
- люмінальний A (HR+/HER2-),
- люмінальний B (HR+/HER2+),
- люмінальний B (HR+/HER2-),
- HER2-позитивний (HR-/HER2+),
- тричі негативний (HR-/HER2-).
Сучасна терапія базується на данній класифікації та передбачає персоналізований підхід до кожної пацієнтки[17].
Гормонозалежні підтипи РМЗ мають рецептори чутливі до естрогену, який стимулює їхній ріст. При цих видах застосовуються препарати, які: блокують рецептори до естрогену – наприклад, ТАМОКСИФЕН. Зменшують синтез естрогену – через інгібітори ароматази (АНАСТРОЗОЛ, ЛЕТРОЗОЛ, ЕКСЕМЕСТАН). Пришвидшують деградацію рецепторів – як це робить ФУЛВЕСТРАНТ, який не тільки блокує рецептор, а й стимулює його руйнування. Інгібітори CDK4/6 (ПАЛБОЦИКЛІБ, РИБОЦИКЛІБ, АБЕМАЦИКЛІБ) – пригнічують ферменти, які регулюють цикл поділу клітини. В результаті пухлинна клітина не може рухатись далі до поділу.
При HER2-позитивні форми пухлини мають занадто багато білка HER2, який стимулює ріст клітини. Проти нього ефективною буде таргетна терапія: ТРАСТУЗУМАБ і ПЕРТУЗУМАБ – це моноклональні антитіла, які блокують роботу HER2, ще й мають здатність залучити імунну систему для знищення пухлини. Інколи використовують комбінацію T-DM1: антитіла і хіміотерапії [23]. Вона знаходить клітину з HER2 і доставляє туди токсичну речовину, не торкаючись здорових тканин.
Найскладніший випадок РМЗ – це тричі негативний рак, при якому відсутні гормональні рецептори та HER2. В цьому випадку використовуються хіміотерапевтичні препарати, які руйнують ДНК або заважають клітинам ділитися. Імунотерапія (ПЕМБРОЛІЗУМАБ) – стимулює власний імунітет, коли ракові клітини маскуються [24]. PARP-інгібітори (ОЛАПАРИБ, ТАЛАЗОПАРИБ) – особливо ефективні при BRCA1/2 мутаціях. Вони блокують фермент PARP, який відновлює пухлинні ДНК [25].
Цікаво знати!
Світовий досвід показує, що імунотерапія, яка раніше застосовувалась переважно при меланомі та недрібноклітинному раку легень, останніми роками також активно впроваджується у лікування РМЗ, зокрема тричі негативного підтипу. Інгібітори контрольних точок, зокрема ПЕМБРОЛІЗУМАБ, відкривають нові можливості для лікування онкологічних захворювань, активуючи власну імунну систему пацієнтки. У нормі рецептор PD-1, що розташований на поверхні Т-клітин, взаємодіє з білками PD-L1 або PD-L2, які можуть експресуватись на пухлинних клітинах. Цей зв'язок «вимикає» активність Т-клітин, обмежуючи їхню здатність розпізнавати й атакувати пухлину. Деякі злоякісні новоутворення користуються цим механізмом, «маскуючись» від імунної системи [21]. Пембролізумаб руйнує це маскування, шляхом блокування рецептора PD-1 і перешкоджанню його взаємодії з лігандами, тим самим відновлюючи активність Т-клітин. У результаті запускається природна протипухлинна імунна відповідь [22].
Особливості сучасної фармакотерапії РМЗ залежно від підтипів узагальнено в схемі 1 [17].
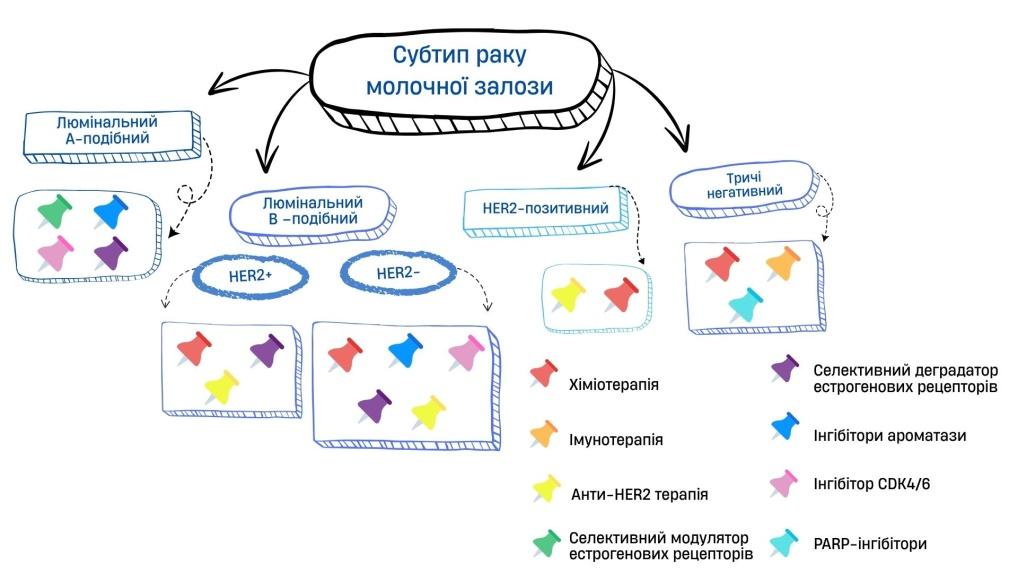
Схема 1. Особливості фармакотерапії раку молочної залози
На основі проведеного аналізу схем системного лікування РМЗ можна простежити чітку тенденцію до диференційованого підходу, який залежить насамперед від біологічного підтипу пухлини та її чутливості до терапії. Сучасні протоколи досить часто передбачають поєднання кількох видів лікування.
Попри значні досягнення, традиційні методи мають певні обмеження. Хіміотерапія, що діє на всі клітини, які швидко діляться, може пошкоджувати не тільки ракові, а й здорові тканини – зокрема слизових оболонки, волосяні фолікули та клітини кісткового мозку. Це спричиняє нудоту, випадіння волосся, втому, імунодефіцит та навіть ризик вторинних онкопатологій. Променева терапія, хоча й спрямована локально, іноді призводить до ураження легеневої або серцевої тканини, а також несе ризик вторинних пухлин. Гормональне лікування має може спричиняти ендокринні порушення, викликати ризику тромбозів та остеопорозу. Хірургічні втручання, зокрема мастектомія, крім фізичного болю і ризику інфекцій, може спровокувати сильний психологічний дискомфорт, пов’язаний із змінами зовнішності. У частини пацієнток формується резистентність до препаратів, іноді лікування виявляється недостатньо ефективним при метастазуванні або важкодоступних пухлинах. Таким чином незважаючи на значні досягнення у підвищенні виживаності, сучасні методи лікування часто супроводжуються значними побічними реакціями, які знижують якість життя пацієнток.
Це зумовлює необхідність пошуку нових підходів, які поєднували б високу точність дії з мінімальними побічними ефектами.
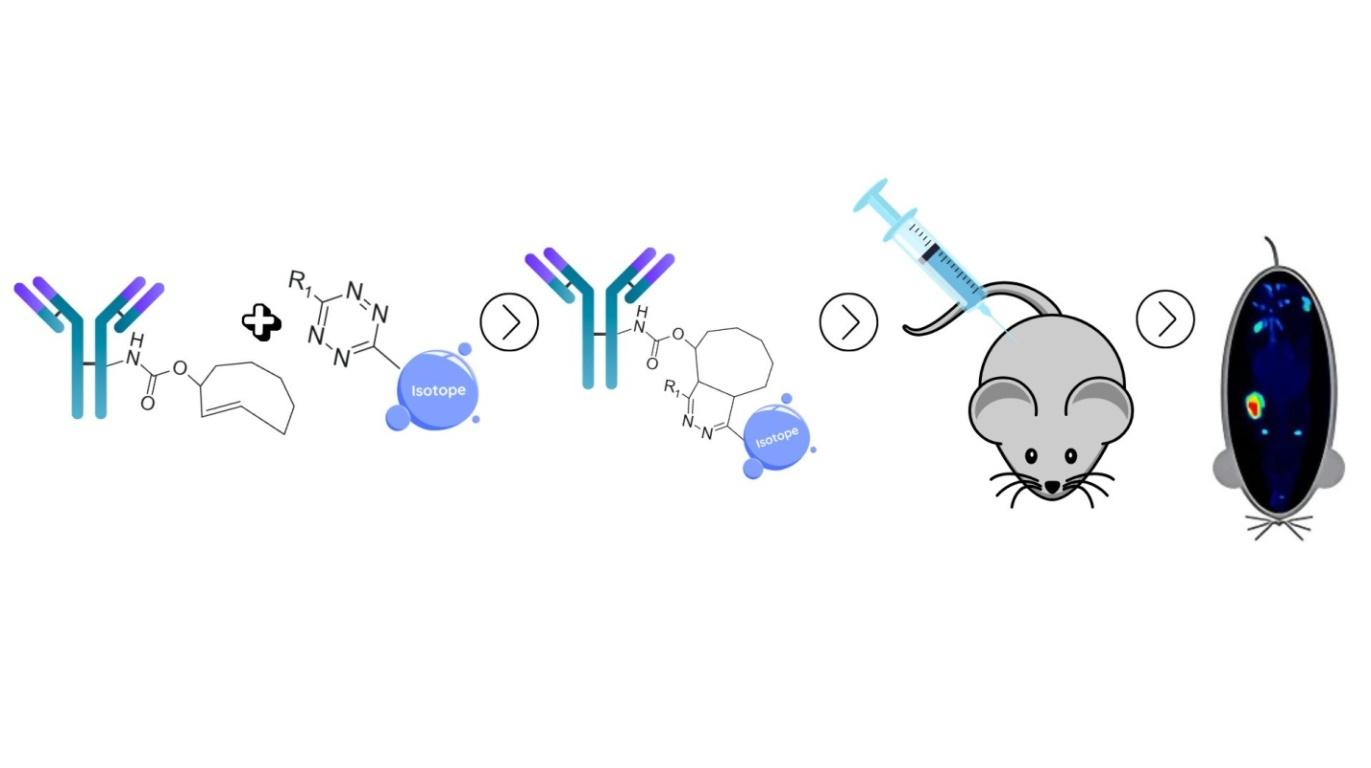
Одним із таких інноваційних напрямів є використання моноклональних антитіл, мічених радіоактивними ізотопами, – так звана радіоімунотерапія. У межах цього методу створюються антитіло-радіонуклідні кон’югати, які поєднують здатність антитіла точно знаходити пухлинну клітину зі здатністю радіоізотопа її знищувати. Антитіло завдяки високій специфічності, прицільно зв’язується з клітиною-мішенню, а радіоактивна частина – як опромінює цю клітину зсередини або поблизу, не пошкоджуючи навколишні тканини, як це показано на рисунку 3.
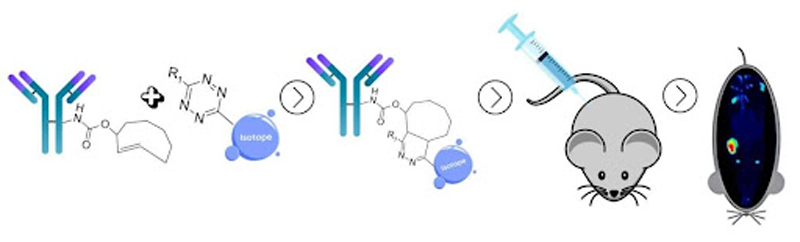
Рисунок 3. Принцип дії міченого трастузумабу
На сьогоднішній день наукові дослідження спрямовані на аналіз фармакологічної активності, безпеки та ефективності використання поєднання трастузумабу з ⁸⁹Zr, ¹¹¹In, ¹³¹I, ¹⁷⁷Lu, ²²⁵Ac та ²¹²Pb. Перші результати поєднання продемонстрували перспективність такого підходу як для діагностики, так і для цілеспрямованої терапії HER2-позитивного раку молочної залози.
Тераностичний підхід дозволяє долати бар’єри, пов’язані з гетерогенністю пухлини, мікрометастазами та ураженням тканин, до яких складно дістатись традиційним препаратам. Сучасні досягнення у сфері фармації та медицини спрямовані на підвищення ефективності лікування при мінімальному навантаженні на організм пацієнтки.
Доступність онкотерапії в Україні
У контексті пріоритетності напрямку профілактики, діагностики та лікування онкологічних захворювань у 2023–2025 роках, Міністерство охорони здоров’я України спільно з Уповноваженим органом з державної оцінки медичних технологій активно працює над розширенням доступу до інноваційних методів терапії. Зокрема, розглядається можливість включення препарату ПАЛБОЦИКЛІБ (інгібітор поділу ракових клітин, який показав ефективність у лікуванні поширеного HR(+), HER2(-) РМЗ у періоді постменопаузи без попередньої терапії метастазів) до переліку лікарських засобів, які підлягають реімбурсації за програмою «Доступні ліки» [27].
Проаналізувавши історію розвитку лікування РМЗ, сучасні клінічні підходи та наявні статистичні дані, можна із впевненістю констатувати новий етап активного й точного лікування даної патології. Ще кілька років тому РМЗ асоціювався з високою смертністю, однак сьогодні, завдяки потужному поступу науки, можна спостерігати підвищення рівня виживаності пацієнтів. За даними Американського товариства боротьби з раком, п’ятирічна виживаність при локалізованому РМЗ перевищує 90% [26], а вчасна діагностика й правильна терапевтична стратегія значно зменшують ризики рецидивів.
Сучасна медицина володіє вже не лише засобами для знищення пухлини, а й механізмами молекулярного контролю. Таргетні препарати, імунотерапія, PARP-інгібітори, а також технології персоналізованої медицини дають змогу впливати саме на ті біологічні мішені, які обумовлюють ріст пухлинних клітин. Кожен новий препарат, кожне вдале клінічне дослідження – це ще один крок до перетворення РМЗ з небезпечної хвороби на контрольований стан. Уже сьогодні є підстави вважати, що в найближчому майбутньому РМЗ перестане бути загрозою для життя мільйонів жінок, а стане ще одним із викликів, на які медицина має гідну відповідь.
Список використанних джерел:
- Giaquinto A. N. et al. Breast cancer statistics, 2022 //CA: a cancer journal for clinicians. – 2022. – Т. 72. – №. 6. – С. 524-541.
- Harvey N. Mayrovitz, The Epidemiology of Breast Cancer, 2022 // Breast cancer. – 2022. – C. 1-19
- Орлова Н. М. та ін. Медико-статистичний аналіз захворюваності, смертності та своєчасності виявлення раку молочної залози в україні, 2024 // Вісник Вінницького національного медичного університету. – 2024. – Т. 28. – №. 1 –С. 113-120.
- Harvey N. Mayrovitz, The Etiology of Breast Cance, 2022 //Breast cancer. – 2022. – C. 1-19
- Фактори ризику для раку молочної залози [Електронний ресурс] // Центр сучасної мамології. – Режим доступу: https://breastcenter.com.ua/information/faktory-ryzyku-dlya-raku-molochnoyi-zalozy/?utm_source=chatgpt.com
- Рак молочної залози: як розпізнати та запобігти [Електронний ресурс] // Центр громадського здоров’я МОЗ України. – 2024. – Режим доступу: https://phc.org.ua/news/rak-molochnoi-zalozi-yak-rozpiznati-ta-zapobigti
- Helsi. Рак молочної залози: симптоми, діагностика та лікування [Електронний ресурс] // Helsi. – 2024. – Режим доступу: https://helsi.me/blog/rak-molochnoi-zalozy-symptomy-diahnostyka-ta-likuvannia
- Benson J. R., Jatoi I. Surgical Oncology of Breast Cancer //Atlas of Diagnosis and Management of Breast Disease. – CRC Press, 2025. – С. 148-159.
- Donegan W. L. History of breast cancer //Breast cancer. – 2006. – С. 1-14.
- Petrakis N. L. A SHORT HISTORY OF BREAST-CANCER-DEMOULIN, D. – 1984.
- Mandell J. B. et al. Bathsheba’s breast Women, cancer & history //The Journal of Clinical Investigation. – 2005. – Т. 115. – №. 6. – С. 1397-1397.
- Jordan V. C. Tamoxifen: a most unlikely pioneering medicine //Nature reviews Drug discovery. – 2003. – Т. 2. – №. 3. – С. 205-213.
- Phillips K. A. et al. A process evaluation trial of a telehealth service intervention to support uptake of breast cancer prevention medications. – 2025.
- Gupta A. et al. Invasive lobular carcinoma integrated multi-omics analysis reveals silencing of Arginosuccinate synthase and upregulation of nucleotide biosynthesis in tamoxifen resistance //bioRxiv. – 2025.
- Miller P. D. Paul D. Miller, MD //Cleveland Clinic Journal of Medicine. – Т. 77. – С. 2.
- Colciago R. R. et al. Factors Influencing Late Breast Toxicity After Radiotherapy: A Scoping Review //BioChem. – 2025. – Т. 5. – №. 2. – С. 13.
- Стандарт медичної допомоги: рак молочної залози [затверджено наказом МОЗ України від 03 лют. 2025 р. № 195]. – К.: МОЗ України, 2025. – 42 с.
- Parakh S. et al. Characterization of mAb104, a mAb Targeting a Conformationally Exposed, Tumor-Specific Epitope of HER2 //Molecular Cancer Therapeutics. – 2025. – С. OF1-OF11.
- Wei Z. et al. Engineered Antibodies as Cancer Radiotheranostics //Advanced Science. – 2024. – Т. 11. – №. 30. – С. 2402361.
- Mirzaabdolah B. et al. Folic Acid-Functionalized Hafnium Oxide Nanoparticles for Radio-Photothermal Combination Therapy and Imaging Enhancement in Breast Cancer Treatment //Available at SSRN 5263844.
- Topalian S. L., Pardoll D. M. Neoadjuvant anti-PD-1-based immunotherapy: evolving a new standard of care //Journal for Immunotherapy of Cancer. – 2025. – Т. 13. – №. 1. – С. e010833.
- Dong J., Zhang L. Prospects on Molecular Targeted Therapy and Immunotherapy for Liver Cancer //Diagnosis and Treatment of Liver Cancer in China. – Springer, Singapore, 2025. – С. 261-284.
- Llombart-Cussac A. et al. Circulating tumor DNA (ctDNA)-based minimal residual disease (MRD) measured by Guardant Reveal in patients (pts) with HER2-positive (HER2+) metastatic breast cancer (mBC) with long-term disease control on first-line trastuzumab-pertuzumab. – 2025.
- Azhar S. et al. Perception on Immune Checkpoint Inhibitor Vanquishing Standard Treatment Paradigm for Triple-negative Breast Cancer.
- Raman R. et al. Targeting Triple‐Negative Breast Cancer: Resistance Mechanisms and Therapeutic Advancements //Cancer Medicine. – 2025. – Т. 14. – №. 9. – С. e70803.
- Американське товариство боротьби з раком. Breast cancer survival rates [Електронний ресурс]. – Режим доступу: https://www.cancer.org/cancer/types/breast-cancer/understanding-a-breast-cancer-diagnosis/breast-cancer-survival-rates.html
- Програма «Доступні ліки» поповниться новими препаратами [Електронний ресурс] // ThePharmaMedia. – 20.03.2025. – Режим доступу: https://thepharma.media/uk/news/37739-programa-dostupni-liki-popovnitsya-novimi-preparatami-20032025