Марина Остапець, кандидат медичних наук, доцент
«Антимікробна резистентність — це глобальна криза, яку ми не можемо ігнорувати… Якщо ми не почнемо боротися з цією загрозою скоординовано та рішуче, вона поверне нас у часи, коли люди боялися звичайних інфекцій і ризикували життям навіть після незначної операції»
Тедрос Аданом Гебреєсус, Генеральний директор ВООЗ
Протягом багатьох тисячоліть історії людства саме інфекційні захворювання були причиною, що визначала тривалість життя людей. Після відкриттів Луї Пастера та Александра Флемінга з кожним роком почали з’являтися нові антибактеріальні препарати. Моніторингові дані свідчать, що за останні десять років глобальне споживання антибіотиків у медицині зросло на 36 %. Однак поряд із різноманітними побічними ефектами антибіотиків, такими як нудота, судоми та діарея, все більш серйозною проблемою для сучасної медицини стають штами мікроорганізмів, стійкі до лікарських засобів. Антибіотикорезистентність (АБР) вже сьогодні входить до переліку глобальних загроз для здоров’я людства, визначених Всесвітньою організацією охорони здоров’я (ВООЗ). За прогнозами експертів ВООЗ, до 2050 року смертність від АБР-нозокоміальних інфекцій зросте у кілька разів. Щороку у світі від них можуть помирати до 100 мільйонів людей, а економічні втрати, пов’язані з лікуванням та наслідками таких інфекцій, можуть сягати 8 трильйонів доларів [1].
***
НА ЗАМІТКУ!
У відповідь на загрозу зростання АБР в Україні в 2016 р. був ухвалений Стратегічний план дій щодо профілактики інфекцій і боротьби з АБР. У документі передбачено впровадження епідеміологічного нагляду, мікробіологічного моніторингу, оптимізацію призначення антибіотиків та удосконалення профілактичних заходів у стаціонарах.
***
Причинами поширення АБР є нераціональне, зокрема, надмірне використання антибіотиків у клінічній практиці (недотримання схем лікування, зловживання антибіотиками, повільне впровадження нових лікарських засобів та неефективний контроль у медичних закладах), сільському господарстві, ветеринарії, а також їх потрапляння в навколишнє середовище. АБР призводить до появи так званих «супербактерій», проти яких сучасні антибіотики стають безсилими. На сьогодні у світі реєструють випадки інфекцій, що не піддаються жодному відомому методу антибактеріальної терапії [1, 2].
Механізми формування резистентності пов’язані зі змінами в генетичному матеріалі бактерій: мутаціями, змінами рівня експресії генів або набуттям нових генів через горизонтальний перенос (через плазміди, транспозони, трансдукцію та трансформацію). Основні механізми включають інактивацію антибіотика специфічними ферментами, зміну мішені дії препарату, зменшення проникності клітинної стінки, активне виведення препарату з клітини та формування метаболічних шунтів [2].
Останніми роками пробіотики викликають не менший (якщо й не більший) інтерес, ніж патогенні супербактерії. Це пов’язано, з одного боку, із сучасним станом АБР, що зумовлює пошук альтернативних антибіотикам більш фізіологічних і безпечних засобів для профілактики й лікування інфекцій, з іншого — розробкою нових біотехнологій, що дають можливість створювати активні й безпечні бактеріальні препарати. Нині пробіотикам відводять важливе місце не тільки в контролі мікробної резистентності, а й як стратегічним засобам альтернативної медицини, спрямованої на підтримку та відновлення здоров’я людини.
Серед основних властивостей пробіотиків можна виділити їх здатність впливати на:
- протиінфекційні захисні механізми;
- забезпечувати імуномодулюючу дію;
- поліпшувати бар’єрні функції;
- нормалізувати метаболічні процеси;
- змінювати моторику й функціональний стан кишківника.
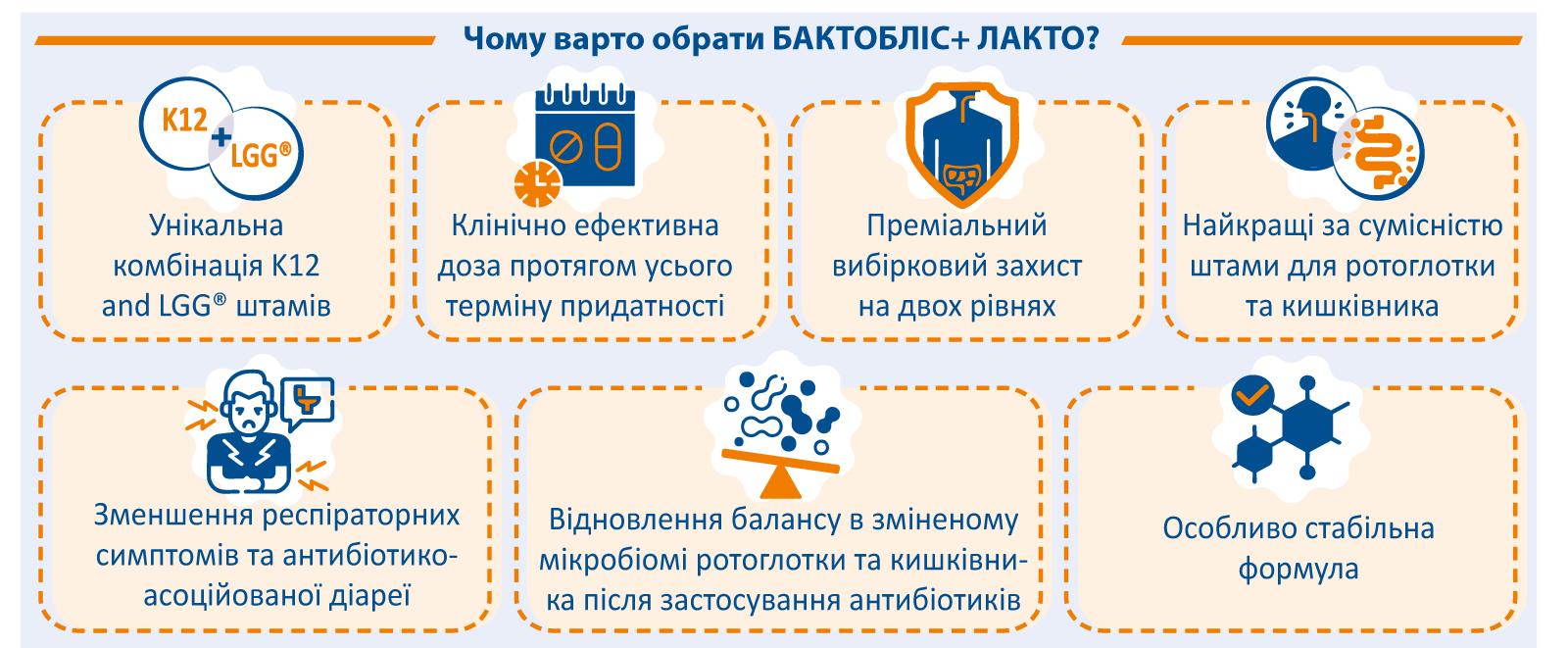
На фармацевтичному ринку України представлена перша пробіотична комбінація К-12 та LGG для одночасного відновлення мікрофлори верхніх дихальних шляхів та кишківника після прийому антибіотиків - БАКТОБЛІС+ ЛАКТО від фармацевтичної компанії «Здраво».
БАКТОБЛІС+ ЛАКТО є унікальною синергічною комбінацією пробіотичних штамів, яка поєднує спрямовану дію на захист верхніх дихальних шляхів завдяки Streptococcus salivarius K12 та підтримку здоров’я кишківника через Lactobacillus rhamnosus LGG. Така формула забезпечує подвійний рівень захисту організму, одночасно зміцнюючи мукозальний імунітет у двох критично важливих бар’єрних зонах. Завдяки комплексному впливу на мікробіоту та імунну систему БАКТОБЛІС+ ЛАКТО сприяє зниженню ризику респіраторних та кишкових інфекцій, підтримує бар’єрну функцію слизових оболонок і сприяє загальному підвищенню резистентності організму.
Складові компоненти БАКТОБЛІС+ ЛАКТО:
Streptococcus salivarius K12
- Streptococcus salivarius — штам корисних бактерій, який у нормі присутній у здоровій ротовій порожнині й становить 40 % від загальної популяції бактерій;
- це бактеріоцинподібна субстанція, захищена понад сорока патентами в різних країнах світу, включно з США, Японією, країнами ЄС і Новою Зеландією;
- має статус GRAS (Generally Recognized as Safe) від FDA (Управління з контролю якості харчових продуктів та лікарських засобів США), тобто офіційно визнаний «безпечним для використання»;
- відіграє важливу роль у відновленні корисної мікрофлори ротоглотки, що відмінно підходить для профілактики інфікування порожнини рота і верхніх дихальних шляхів;
- формує захисний мікробіом після прийому антибіотиків та запобігає росту умовно-патогенної та патогенної мікрофлори;
- утворює два антибактеріальних бактеріоцини (саліваріцин А2 та саліваріцин В), що пригнічує ріст збудників інфекцій у ротоглотці.
Lactobacillus rhamnosus LGG
- найбільш досліджений пробіотичний штам у світі. За 30 років проведено понад 250 клінічних випробувань, а його ефективність підтверджена як у дітей, так і в дорослих;
- використання LGG з антибіотиками зменшує кількість та тривалість епізодів діареї, а також веде до нормалізації стільця;
- стійкий до дії соляної кислоти шлунка та жовчі, що важливо для успішного проходження через шлунково-кишковий тракт із подальшим відновленням мікробіому кишківника;
- безпечний для споживання людиною, має статус QPS (Кваліфікованої презумпції безпеки) у Європі та статус GRAS від FDA.
БАКТОБЛІС+ ЛАКТО рекомендований:
- при кожному курсі антибіотиків — для підтримки та захисту нормальної мікрофлори організму, запобігаючи негативному впливу антибіотиків на корисні бактерії;
- для запобігання та лікування антибіотик-асоційованої діареї — зменшує ризик розвитку діареї, спричиненої порушенням мікробіоти, та сприяє швидшому відновленню нормальної функції кишківника;
- для полегшення респіраторних симптомів у період антибіотикотерапії — допомагає знизити частоту та інтенсивність запальних проявів у верхніх дихальних шляхах, пов’язаних із зниженням місцевого імунітету;
- для відновлення балансу мікробіоти ротоглотки та кишківника після лікування антибіотиками — сприяє нормалізації захисного біоплівкового шару слизових оболонок, запобігаючи колонізації патогенними мікроорганізмами та підтримуючи імунний захист.
Доказова ефективність та безпека компонентів комплексу БАКТОБЛІС+ ЛАКТО
Streptococcus salivarius K12
У дослідженні Chen T. Y. та співавт. показано, що Streptococcus salivarius K12 пригнічує широкий спектр бактеріальних патогенів дихальних шляхів, особливо Streptococcus pyogenes (основний збудник ангіни), а також Streptococcus pneumoniae та Moraxella catarrhalis [3].
Потужна антибактеріальна активність Streptococcus salivarius K12 зумовлена, насамперед, його здатністю продукувати набір бактеріоцинів, зокрема лантибіотики саліварицин А2 та саліварицин В, які руйнують клітинні мембрани бактерій [4].
Результати досліджень Lawrence G. W. та співавт. також продемонстрували ефективність саліварицину А та саліварицину В проти Fusobacterium nucleatum – ключового чинника пародонтальної хвороби, який дедалі частіше пов’язують з етіологією раку товстої кишки. Це підкреслює потенційні системні можливості Streptococcus salivarius K12, розширюючи його корисну дію в профілактиці онкологічних захворювань шлунково-кишкового тракту [5].
Streptococcus salivarius K12 проявляє імуномодулюючу дію, врівноважуючи баланс про- та протизапальних цитокінів. Надмірне запалення, наприклад, «цитокінові шторми» при вірусних інфекціях, таких, як COVID-19, може спричиняти значні пошкодження тканин. У праці Laws G. L. та співавт. [6] повідомлялося, що зниження рівня ключового системного протизапального цитокіну IL-10 може призводити до серйозних ускладнень під час вірусних інфекцій. Модулюючи запальні реакції без пригнічення здатності імунної системи боротися з інфекціями, Streptococcus salivarius K12 допомагає зменшити тяжкість перебігу захворювань і водночас сприяє елімінації вірусних патогенів. Такий «тонкий» контроль запалення особливо важливий при вірусних інфекціях, де критично значущою є збалансована імунна відповідь.
Ще один ключовий механізм дії Streptococcus salivarius K12 — посилення місцевих імунних реакцій слизових оболонок, особливо верхніх дихальних шляхів. Di Pierro та співавт. [7] виявили, що у дітей, які отримували Streptococcus salivarius K12, частота вірусних фаринго-тонзилітів була нижчою, що пов’язували зі збільшенням продукції гамма-інтерферону. У свою чергу, гамма-інтерферон відіграє ключову роль у противірусному імунітеті, активуючи макрофаги та природні кілери (NK-клітини), а також стимулюючи презентацію вірусних антигенів. Така посилена імунна відповідь забезпечує ефективне розпізнавання та знищення вірусних загроз, включно з SARS-CoV-2.
Крім того, Macdonald K. W. та співавт. виявили, що Streptococcus salivarius K12 здатний зменшувати запалення, спричинене бактеріальними патогенами [8].
У дослідженні Di Pierro F. та співавт. показано, що діти, які отримували Streptococcus salivarius K12, мали значно менше епізодів вірусного фаринго-танзиліту та гострого середнього отиту, ніж діти у групі плацебо [7].
У дослідженні Wang Q. та співавт. [9] серед медичних працівників, які боролися з COVID-19, у групі, що приймала Streptococcus salivarius K12, було зафіксовано на 64 % менше випадків респіраторних інфекцій порівняно з контрольною групою. Ці результати узгоджуються з даними про здатність Streptococcus salivarius K12 знижувати частоту респіраторних вірусних інфекцій, включно з тими, що спричинені грипом, риновірусом та навіть SARS-CoV-2. Пробіотик досягає цього завдяки модулюванню місцевого імунітету та конкурентному пригніченню прикріплення вірусів до клітин, що підсилює імунну відповідь на вірусні загрози.
Під час пандемії COVID-19 інше дослідження Di Pierro F. [10] виявило, що жодна дитина, яка приймала Streptococcus salivarius K12, не інфікувалася SARS-CoV-2, тоді як у контрольній групі випадки інфекцій були зафіксовані. Це свідчить про потенційний захисний ефект пробіотика проти вірусних збудників.
Ефективність Streptococcus salivarius K12 у запобіганні бактеріальним інфекціям добре підтверджена, особливо в контексті підтримки збалансованого мікробіому, що є критично важливим для здоров’я дихальних шляхів. Вторинні бактеріальні інфекції, зокрема, спричинені Streptococcus pyogenes, значно погіршують перебіг вірусних захворювань, таких як грип чи SARS-CoV-2. Дослідження показують, що Streptococcus salivarius K12 здатний зменшувати кількість бактеріальних ускладнень. Зокрема, у дітей, які приймали пробіотик, зафіксовано суттєве зниження частоти рецидивуючого стрептококового фарингіту [11].
Дослідження Sarlin S. та співавт. [12] і Cernioglo К. та співавт. [13] підтверджують, що Streptococcus salivarius K12 сприяє збереженню здорового мікробіому, що є ключовим фактором у профілактиці вторинних інфекцій під час вірусних захворювань. Збалансований мікробіом ще до зараження вірусом може значно знизити ризик бактеріальних ускладнень і тим самим додатково зміцнити здоров’я дихальних шляхів.
Streptococcus salivarius K12 — це пробіотичний штам, що зменшує бактеріальне навантаження в ротовій порожнині та носоглотці, допомагає зберігати мікробний баланс і стримує розмноження патогенів під час вірусних захворювань. Це відіграє важливу роль у профілактиці бактеріальних суперінфекцій. Streptococcus salivarius K12 може зменшувати ймовірність таких ускладнень, зберігаючи цілісність слизових оболонок, конкуруючи з патогенами за місце прикріплення та перешкоджаючи їх адгезії. Його подвійна дія — запобігання колонізації бактеріями та стимуляція місцевого імунітету — створює ефективний захисний бар’єр проти вторинних бактеріальних інфекцій. Це знижує потребу в антибіотиках та допомагає боротися з проблемою АБР.
Здатність Streptococcus salivarius K12 регулювати мікробіоту, запобігати бактеріальним суперінфекціям та зменшувати тяжкість захворювань підкреслює його важливу роль у комплексних стратегіях підтримки респіраторного здоров’я. Отримані дані підтверджують його подвійну ефективність у боротьбі як з вірусними, так і з бактеріальними інфекціями, пропонуючи цілісне пробіотичне рішення для покращення здоров’я та профілактики ускладнень.
Lactobacillus rhamnosus LGG
Збереження цілісності кишкового бар’єра є однією з ключових властивостей LGG®. Численні експериментальні дослідження переконливо продемонстрували позитивний вплив LGG® на стан кишкового бар’єра шляхом стабілізації щільних контактів [14]. У клінічних дослідженнях LGG® показав ефективність у покращенні перебігу різних гастроінтестинальних розладів у пацієнтів різного віку. Такий позитивний вплив вважається ключовим фізіологічним механізмом, що лежить в основі цих клінічних ефектів [15].
Однією з характерних ознак взаємодії LGG® з імунною системою є стимуляція проліферації регуляторних Т-клітин. Експериментальні дані послідовно демонструють, що LGG® сприяє диференціації Т-лімфоцитів у субпопуляцію, що підтримує гомеостаз та регуляцію імунних реакцій у кишківнику [16].
Пробіотичні мікроорганізми можуть взаємодіяти з організмом господаря по всій довжині шлунково-кишкового тракту, однак з огляду на нижчу щільність бактеріальної колонізації у тонкій кишці та особливості її анатомічної будови, найбільш значущі у фізіологічному відношенні взаємодії, насамперед, відбуваються саме в цій ділянці. У складі LGG® ідентифіковано низку поверхневих молекул, що впливають на слизову оболонку кишківника та імунну систему, зокрема, пілі, пептидоглікан, ліпотейхоєву кислоту, екзополісахариди, а також секретовані білки p40, p75 та HM0539. Крім того, білки p40 та p75 захищають кишковий епітелій від оксидативного стресу за рахунок зменшення уражених щільних та адгезивних контактів.
Доведено, що LGG® знижує рівень багатьох прозапальних цитокінів, зокрема, фактора некрозу пухлин альфа, інтерлейкінів та інтерферону γ, а також низки хемокінів [17].
LGG® може зменшувати тяжкість і тривалість респіраторних інфекцій, підсилювати імунну відповідь і знижувати рівень запалення у дихальних шляхах [17].
Важливу роль у збереженні здоров’я дихальної системи відіграє кишково-легенева вісь. Склад мікробіоти кишечника впливає на функцію імунної системи, і дисбіоз пов’язують із розвитком респіраторних патологій. Дослідження щодо використання пробіотиків, включно зі штамами Bifidobacterium breve, Lactobacillus reuteri та Lactobacillus casei, показали їхній потенціал у підтримці здоров’я дихальних шляхів [18].
Порівняно з іншими пробіотичними штамами, LGG має унікальні властивості, зокрема, здатність виживати в кислому середовищі шлунка й адгезуватися до епітеліальних клітин кишечника, що посилює його імуномодулювальний ефект [17, 18].
Отже, LGG® здатний пригнічувати інгібувати цитокін-індукований запальний процес, зберігати функціональну цілісність кишкового бар’єра, стимулювати продукцію слизу, підтримувати імунну толерантність і гомеостаз, активувати синтез імуноглобуліну A (IgA), що захищає від розвитку запального стану кишківника, а також зменшує тяжкість та тривалість респіраторних інфекцій за рахунок збереження кишково-легеневої вісі.
Література:
- Huemer, M., Mairpady Shambat, S., Brugger, S. D., & Zinkernagel, A. S. (2020). Antibiotic resistance and persistence-Implications for human health and treatment perspectives. EMBO reports, 21(12), e51034.
- Larsson, D. G. J., & Flach, C. F. (2022). Antibiotic resistance in the environment. Nature reviews. Microbiology, 20(5), 257–269.
- Chen, T.Y.; Hale, J.D.F.; Tagg, J.R.; Jain, R.; Voss, A.L.; Mills, N.; Best, E.J.; Stevenson, D.S.; Bird, P.A.; Walls, T. In vitro Inhibition of Clinical Isolates of Otitis Media Pathogens by the Probiotic Streptococcus salivarius BLIS K12. Probiotics Antimicrob. Proteins 2021, 13, 734–738.
- Hyink, O.; Wescombe, P.A.; Upton, M.; Ragland, N.; Burton, J.P.; Tagg, J.R. Salivaricin A2 and the Novel Lantibiotic Salivaricin B Are Encoded at Adjacent Loci on a 190-Kilobase Transmissible Megaplasmid in the Oral Probiotic Strain Streptococcus salivarius K12. Appl. Environ. Microbiol. 2007, 73, 1107–1113.
- Lawrence, G.W.; McCarthy, N.; Walsh, C.J.; Kunyoshi, T.M.; Lawton, E.M.; O’connor, P.M.; Begley, M.; Cotter, P.D.; Guinane, C.M. Effect of a bacteriocin-producing Streptococcus salivarius on the pathogen Fusobacterium nucleatum in a model of the human distal colon. Gut Microbes 2022, 14, 2100203.
- Laws, G.L.; Hale, J.D.F.; Kemp, R.A. Human Systemic Immune Response to Ingestion of the Oral Probiotic Streptococcus salivarius BLIS K12. Probiotics Antimicrob. Proteins 2021, 13, 1521–1529.
- Di Pierro, F.; Colombo, M.; Zanvit, A.; Risso, P.; Rottoli, A.S. Use of Streptococcus salivarius K12 in the prevention of streptococcal and viral pharyngotonsillitis in children. Drug Healthc. Patient Saf. 2014, 6, 15–20.
- MacDonald, K.W.; Chanyi, R.M.; Macklaim, J.M.; Cadieux, P.A.; Reid, G.; Burton, J.P. Streptococcus salivarius inhibits immune activation by periodontal disease pathogens. BMC Oral Health 2021, 21, 245.
- Wang, Q.; Lin, X.; Xiang, X.; Liu, W.; Fang, Y.; Chen, H.; Tang, F.; Guo, H.; Chen, D.; Hu, X.; et al. Oropharyngeal Probiotic ENT-K12 Prevents Respiratory Tract Infections Among Frontline Medical Staff Fighting Against COVID-19: A Pilot Study. Front. Bioeng. Biotechnol. 2021, 9, 646184.
- Di Pierro, F.; Colombo, M. The administration of S. salivarius K12 to children may reduce the rate of SARS-CoV-2 infection. Minerva Medica 2021, 112, 514–516
- Tagg, J.R.; Harold, L.K.; Jain, R.; Hale, J.D.F. Beneficial modulation of human health in the oral cavity and beyond using bacteriocin-like inhibitory substance-producing streptococcal probiotics. Front. Microbiol. 2023, 14, 1161155.
- Sarlin, S.; Tejesvi, M.V.; Turunen, J.M.; Vänni, P.M.; Pokka, T.M.; Renko, M.; Tapiainen, T. Impact of Streptococcus salivarius K12 on Nasopharyngeal and Saliva Microbiome: A Randomized Controlled Trial. Pediatr. Infect. Dis. J. 2020, 40, 394–402.
- Cernioglo, K.; Kalanetra, K.M.; Meier, A.; Lewis, Z.T.; Underwood, M.A.; Mills, D.A.; Smilowitz, J.T. Multi-Strain Probiotic Supplementation with a Product Containing Human-Native S. salivarius K12 in Healthy Adults Increases Oral S. salivarius. Nutrients 2021, 13, 4392.
- Gao, J.; Li, Y.; Wan, Y.; Hu, T.; Liu, L.; Yang, S.; Gong, Z.; Zeng, Q.; Wei, Y.; Yang, W.; et al. A Novel Postbiotic from Lactobacillus rhamnosus GG with a Beneficial Effect on Intestinal Barrier Function. Front. Microbiol. 2019, 10, 477.
- Gotteland, M.; Cruchet, S.; Verbeke, S. Effect of Lactobacillus Ingestion on the Gastrointestinal Mucosal Barrier Alterations Induced by Indometacin in Humans. Aliment. Pharmacol. Ther. 2001, 15, 11–17.
- Zhang, J.; Ma, J.Y.; Li, Q.-H.; Su, H.; Sun, X. Lactobacillus rhamnosus GG Induced Protective Effect on Allergic Airway Inflammation Is Associated with Gut Microbiota. Cell Immunol. 2018, 332, 77–84.
- Han SK, Shin YJ, Lee DY, Kim KM, Yang SJ, Kim DS, et al. Lactobacillus rhamnosus HDB1258 modulates gut microbiota-mediated immune response in mice with or without lipopolysaccharide-induced systemic inflammation. BMC Microbiol. 2021;21:146.
- Chunxi L, Haiyue L, Yanxia L, Jianbing P, Jin S. The gut microbiota and respiratory diseases: New evidence. J Immunol Res. 2020;2020:2340670.